Вещества, у которых не возможен переход электронов из валентной энергетической зоны в зону проводимости.
Согласно зонной энергетической структуры кристалла валентная зона не перекрывается с зоной проводимости, когда величина ΔE на порядки больше тепловой энергии (при комнатной температуре ~ 0,1 эВ). Этому случаю отвечает образование полупроводников и диэлектриков . Типичные диэлектрики есть как среди ионных кристаллов, например LiF и CaF2 ( =12 эВ), так и среди ковалентных кристаллов, например алмаз ( =5,3 эВ).
На границе между полупроводниками и диэлектриками находится карбид кремния SiC (ΔE=3 эВ). В рассмотренных случаях валентная зона кристалла занята полностью. Например, в случае ионного диэлектрика (LiF, CaF2, MgO, NaСl и др.) валентная зона заполнена электронами, локализованными на анионах, а пустая зона проводимости связана с вакантными орбиталями катионов. В алмазе и полупроводниках с подобной ему структурой валентная зона полностью занята электронами, которые можно рассматривать как локализованные на двухэлектронных связях, образованных направленными гибридными sp3-орбиталями соседних атомов.
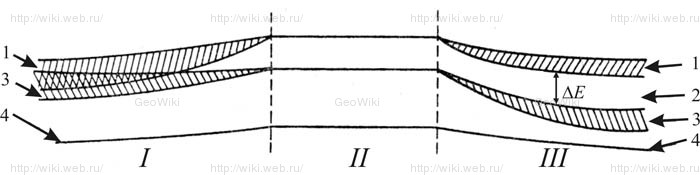
Схема взаимного расположения энергетических зон: I - металла, II - уровни изолированного атома, III - полупроводника и диэлектрика;
1 - зона проводимости, 2 - запрещенная зона, 3 - валентная зона, 4 - внутренний уровень. , ΔE – ширина запрещенной зоны (2).
Все ковалентные твердые тела, подчиняющиеся правилу Юм-Розери KЧ = 8 - N, не могут быть проводниками. В таких веществах каждый атом получает возможность укомплектовать свой электронный октет с помощью ковалентных или существенно ковалентных связей и валентная зона оказывается полностью занятой.
Литература:
- Урусов В.С., Ерёмин Н.Н. Кристаллохимия, краткий курс., М., МГУ, 2004.

